Выявление мутаций в генах, кодирующих ферменты цикла фолиевой кислоты: MTHFR и MTRR
Невынашивание беременности (НБ) – это универсальный интегрированный ответ женского организма на любое неблагополучие здоровья беременной и плода, кумулятивный (интегрированный) ответ на действие неблагоприятных экзогенных и эндогенных факторов.
Проблема невынашивания беременности затрагивает многие семейные пары. Частота невынашивания беременности составляет от 10 до 25% всех беременностей. Решение этой проблемы требует комплексного подхода.
На протяжении последних 50 лет понятие генетические причины НБ включало в себя только наличие хромосомных поломок у супругов и плода.
Но НБ может быть обусловлено и наличием наследственной предрасположенности.
НБ– это результат действия «функционально-ослабленных» вариантов множества генов на фоне неблагоприятных внешних и внутренних факторов.
В настоящее время установлена целесообразность генетического тестирования полиморфизма (мутаций) нескольких генов для установления причин невынашивания беременности:
1) Гены, кодирующие ферменты цикла фолиевой кислоты: MTHFR и MTRR
2) Гены, кодирующие ферменты II фазы детоксикации: GSTMI, GSTTI, GSTPI
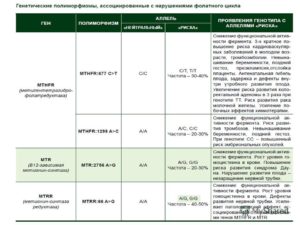
Показания к назначению молекулярно-генетического анализа на полиморфизм генов метаболизма (MTRR и MTHFR)
- Рождение в семье ребенка с изолированными пороками пороками нервной трубки, сердца или урогенитального тракта;
- Невынашивание и другие осложнения, связанные с беременностью;
- Плановая подготовка к беременности.
- Выявление у пациента гипергомоцистинемии;
- Наличие у пациента ИБС, артериальной гипертонии;
- Наличие у пациента родственников I и II степени родства ИБС, артериальной гипертонии;
1) Ген метилентетрагидрофолатредуктазы MTHFR C677T
Функция:Фермент является ключевым звеном фолатного цикла и катализирует реакцию превращения гомоцистеина в метионин.
Гомоцистеин — серосодержащая аминокислота, являющаяся продуктом переработки в организме так называемой незаменимой аминокислоты метионина.
Гомоцистеин под воздействием фолиевой кислоты и витамина В-12 возвращается обратно в метионин, или под влиянием витамина В-6 превращается в следующий продукт обмена цистотионин.
Повышение уровня гомоцистеина крови на 5 мкмоль/л приводит к увеличению риска атеросклеротического поражения сосудов на 80% у женщин и на 60% у мужчин.
[attention type=yellow]У людей с повышенным уровнем гомоцистеина повышается риск возникновения болезни Альцгеймера и старческого слабоумия.
[/attention]При сочетании повышения гомоцистеина крови и сахарного диабета чаще возникают сосудистые осложнения — заболевания периферических сосудов, нефропатия, ретинопатия и др.
Причина повышенного уровня гомоцистеина крови:Вариант С677Т в генеMTHFR-мутация в гене фермента метилентетрагидрофолатредуктазы.
Замена цитозина на тимин в 677 положении приводит к снижению функциональной активности фермента до 35% от среднего значения.
Полиморфизм 677C>T (A223V) широко распространен в различных популяциях и связан по крайней мере с двумя группами многофакторных заболеваний — васкулярными заболеваниями и дефектами развития нервной трубки у плода.
Дефекты в данном гене часто приводят к совершенно различным заболеваниям с широким спектром клинических симптомов: умственное и физическое отставание в развитии, перинатальная смерть, васкулярные и нейродегенеративные заболевания, диабет, рак и другие.
Во время беременности в норме уровень гомоцистеина в плазме понижен. Это можно рассматривать, как физиологическую адаптацию организма матери, направленную на поддержание адекватной циркуляции крови в плаценте.
У носителей варианта Т во время беременности наблюдается дефицит фолиевой кислоты, что приводит к дефектам развития нервной трубки у плода.
Курение усугубляет влияние варианта 677T.
Клинические проявления:
- гестоз, преждевременная отслойка нормально расположенной плаценты, задержка внутриутробного развития плода, антенатальная гибель плода;
- дефект развития нервной трубки плода (spina bifida), анэнцефалия, умственная отсталость ребенка, «заячья губа», «волчья пасть»;
- преждевременное развитие сердечно-сосудистых заболеваний (атеросклероз!), артериальные и венозные тромбозы.
Назначение фолиевой кислоты может значительно снизить риск последствий данного варианта полиморфизма
- Данные о полиморфизме:частота встречаемости гомозиготы в популяции – 10-12%
- частота встречаемости гетерозиготы в популяции – 40%
- аутосомно-рецессивное наследование
2) Ген метилентетрагидрофолатредуктазы MTRR 66A->G
Функция:Ген MTRR кодирует фермент редуктазу метионинсинтазы (MTRR), участвующий в большом количестве биохимических реакций, связанных с переносом метильной группы. Одной из функций MTRR является обратное превращение гомоцистеина в метионин. В качестве кофактора в этой реакции принимает участие витамин В12 (кобаламин).
Полиморфизм 66 A->G связан с аминокислотной заменой в молекуле фермента MTRR.
Результат—функциональная активность фермента снижается, что приводит к повышению риска нарушений развития плода — дефектов нервной трубки.
Влияние полиморфизма усугубляется дефицитом витамина В12. При сочетании полиморфизма 66 A->G гена MTRR с полиморфизмом 677C->T в гене MTHFR риск spina bifida увеличивается.
Полиморфизм 66А->G гена MTRR также усиливает гипергомоцистеинемию, вызываемую полиморфизмом 677C->T в гене MTHFR.
Данные о полиморфизме:
Частота встречаемости варианта G полиморфизма в популяции:
- G/G — 15-25%,
- A/G — 40-50%.
- Преобладающий генотип в популяции: (A/G)
Материал для исследования:
венозная кровь, буккальный эпителий
| Кат.№ | Наименование анализа | Сокращенное наименование анализа | Срок выполнения |
| II.3.8 | Мутация 677C>T метилентетрагидро-фолатредуктазы (MTHFR) | MTHFR 677C>T | 7 дней |
| II.3.9 | Мутация 66A>G редуктазы метионинсинтетазы (MTRR) | MTRR A>G | 7 дней |
Для юридических лиц:
По вопросам сотрудничества с нашей лабораторией Вы можете связаться с нами любым удобным способом:
- По телефону: +7 (383) 334 86 14
- e-mail: info@biolinklab.ru
- C помощью контактной формы:
Физические лица (пациенты) могут пройти данное исследование в обособленном подразделении лаборатории «БиоЛинк» Медицинском центре «Статус» по адресу: г. Новосибирск, ул. Владимировская д. 2/1, тел. +7 (383) 248 90 09.
Источник: https://biolinklab.ru/vyyavlenie-mutacij-v-genax-kodiruyushhix-fermenty-cikla-folievoj-kisloty-mthfr-i-mtrr/
Центр Молекулярной Генетики — Все о синдроме Жильбера

Синдром Жильбера — наследственная доброкачественная негемолитическая непрямая гипербилирубинемия (повышение непрямой фракции желчного пигмента билирубина в крови). Заболевание впервые было описано французским гастроэнтерологом Gilbert с соавторами в 1901 году.
Синдром Жильбера является наиболее часто встречающимся заболеванием из группы наследственных гипербилирубинемий. В популяции частота синдрома составляет 5-10%. Количество носителей достигает 40%.
Основным и зачастую единственным клиническим признаком заболевания является повышение уровня общего билирубина сыворотки крови за счет непрямой фракции билирубина в пределах 20-100 мкмоль/мл. Внешние проявления при синдроме Жильбера могут отсутствовать либо представлены небольшой желтушностью кожных покровов, склер.
Кроме того возможны диспептические явления, боли в правом подреберье. В редких случаях наблюдаются клинические проявления со стороны центральной нервной системы: усталость, головокружение, головные боли, нарушение памяти.
В основе заболевания лежит дефект в гене UGT1A1, приводящий к снижению активности фермента печени уридин-дифосфат-глюкуронозилтрансферазы 1 (УДФ-ГТ1). Предполагается, что тип наследования синдрома Жильбера — аутосомно-рецессивный, те вероятность рождения ребенка с синдромом Жильбера у родителей-носителей мутации в гене UGT1 A1 составляет 25%.
Клинические признаки и лабораторно-инструментальные показатели присиндроме Жильбера
Первые признаки заболевания, как правило, проявляются в возрасте 15-30 лет. Провоцирующими факторами возникновения клинических признаков являются стрессовые ситуации, физическое перенапряжение, погрешности в питании (употребление жирных, консервированных продуктов, алкоголя), голодание, острые инфекционные заболевания, прием лекарственных препаратов с гепатотоксическими свойствами.
Основным клиническим признаком является постоянная или периодически возникающая желтушность небольшой интенсивности кожных покровов и/или склер, слизистой оболочки рта. Типично желтушное окрашивание стоп, ладоней, носогубного треугольника, подмышечных впадин.
Со стороны желудочно-кишечного тракта возможны диспептические явления (изжога, тошнота, вздутие живота), потеря аппетита, боль в животе и правом подреберье, непереносимость углеводов, алкоголя, гипогликемическая реакция на продукты питания. При функционально-инструментальном исследовании размеры печени остаются в пределах нормы либо увеличены незначительно.
[attention type=red]В редких случаях наблюдаются проявления со стороны центральной нервной системы: головные боли, головокружение, бессоница, раздражительность, трудности с концентрацией внимания, нарушение памяти, депрессия, приступы паники, тремор.
[/attention]В биохимическом анализе крови выявляется повышение общего билирубина в пределах 20-100 мкмоль/мл со значительным преобладанием его непрямой фракции. Остальные биохимические показатели крови и печеночные пробы не изменены.
Причины синдрома Жильбера
Синдром Жильбера – наследственное заболевание, при котором снижена функциональная активность фермента УДФ-ГТ1. Данный фермент кодируется геном UGT1A1, расположенном на 2-ой паре хромосом в районе 2q37.
Основным и обязательным генетическим дефектом при синдроме Жильбера является дополнительная динуклеотидная вставка тимидин-аденин (ТА) в области ТА-повтора в промоторной (регуляторной) области гена UGT1A1.
Значимость ТАТАА последовательности промоторной области гена UGT1A1 заключается в том, что он является сайтом связывания для транскрипционного фактора, необходимого для инициации процесса транскрипции гена.
В норме промоторная область гена UGT1A1 содержит 6 ТА-повторов. Генотип А(ТА)6ТАА/А(ТА)6ТАА соответствуют нормальной функциональной активности фермента УДФ-ГТ1.
Для синдрома Жильбера характерна обратная зависимость между увеличением ТА повторов в промоторной области гена UGT1A1 и активностью фермента УДФ-ГТ1: увеличение ТА повторов ведёт к снижению экспрессии гена UGT1A1 и как следствие к снижению функциональной активности фермента УДФ-ГТ1.
Так, при увеличении количества ТА повторов до 7 в гомозиготном состоянии (генотип А(ТА)7ТАА/А(ТА)7ТАА) наблюдается снижение ферментативной активности УДФ-ГТ1 примерно на 30%.
[attention type=green]У гетерозиготных носителей дополнительной вставки ТА в промоторе гена UGT1A1 (генотип А(ТА)6ТАА/А(ТА)7ТАА) также может выявляется гипербилирубинемия, но менее выраженная, в виду снижения ферментативной активности УДФ-ГТ1 в среднем на 14%.
[/attention]Помимо вставки дополнительных ТА динуклеотидов в промоторном регионе гена синдром Жильбера может быть ассоциирован с частой мутацией Gly71Arg в кодирующей области гена UGT1A1.
Патогенез синдрома Жильбера
Желчный пигмент билирубин – продукт распада гемоглобина (95%) и гемсодержащих ферментов. В организме существует две фракции данного соединения: непрямой свободный билирубин в связи с альбумином плазмы крови и прямой билирубин, связанный с глюкуроновой кислотой (билирубин-диглюкуронид).
Распад гема (небелковой железосодержащей части гемоглобина) осуществляется в ретикулоэндотелиальных клетках печени, селезёнки, костного мозга. В результате образуется пигмент биливердин. Далее фермент биливердин-редуктаза катализирует превращение биливердина в билирубин.
В плазме крови билирубин связывается с альбумином (непрямой неконъюгированный билирубин) и в такой форме доставляется в печень, где происходит переход билирубина от альбумина на синусоидальную поверхность гепатоцитов.
Неконъюгированная свободная форма билирубина является жирорастворимой, поэтому для выведения билирубина из организма необходимо его трансформировать в водорастворимую форму путём его конъюгации (соединения) с глюкуроновой кислотой.
Процесс конъюгирования билирубина с глюкуроновой кислотой в гепатоцитах происходит при помощи фермента уридин-дифосфат-глюкуронозил-трансферазы 1 (УДФ-ГТ1).
В результате данной реакции происходит образование сначала билирубин-моноглюкуронида, в ходе дальнейшей реакции конъюгации билирубин-моноглюкуронида с глюкуроновой кислотой, также катализируемой ферментом УДФ-ГТ1, образуется водорастворимая форма билирубина — билирубин-диглюкуронид. Таким образом, фермент УДФ-ГТ1 является главным ферментом в реакции глюкуронизации билирубина. При синдроме Жильбера УДФ-ГТ1 обладает сниженной ферментативной активностью в среднем на 30 %, что приводит к накоплению непрямого билирубина в организме с возможным проявлением его токсических свойств.
Для синдрома Жильбера характерно повышение в крови концентрации только непрямой фракции билирубина.
Соответственно такой биохимический показатель как общий уровень билирубина в крови, складывающийся из двух составляющих (прямой и непрямой билирубин) при данном заболевании также завышен.
Так, концентрация общего билирубина в крови при синдроме Жильбера варьирует в пределах 20-50 мкмоль/л, но в период обострения заболевания может достигать значения до 100 мкмоль/л.
Прием лекарственных средств при синдроме Жильбера
Лекарственные вещества, попадая в организм, подвергаются биотрансформации, то есть претерпевают ряд физико- и биохимических превращений, в процессе которых образуются метаболиты (водорастворимые вещества), легковыводящиеся из организма. Данные процессы обеспечиваются слаженной работой ряда ферментативных систем организма, отличающихся по уровню активности у каждого человека, что обуславливает индивидуальную чувствительность к различным фармакологическим препаратам.
Главным органом метаболизации лекарств является ферментативная система печени, где протекают две основные фазы биотрансформации веществ:
- метаболическая трансформация, включающая реакции окисления, восстановления и гидролиза, катализизируемые микросомальной ферментативной системой цитохрома Р450;
- конъюгация с различными субстратами, в результате которой высокомолекулярные вещества превращаются в водорастворимые соединения, способные к выведению с желчью. На данной стадии значительную роль играет ферментативное семейство уридиндифосфатглюкуронидаз, которые катализируют реакцию конъюгации различных субстратов с глюкуроновой кислотой.
Кроме билирубина специфическими субстратами для семейства ферментов УДФ-ГТ являются гормоны (стероидные, гормоны щитовидной железы), простые фенолы, катехоламины, флавоноиды.
Также имеются данные об участии фермента УДФ-ГТ1 в метаболизме лекарств: противоопухолевого препарата иринотекана, траниласта, парацетамола.
Учитывая высокую частоту синдрома Жильбера в популяции, рекомендуется проводить генетический анализ перед началом лечения лекарственными препаратами, обладающих гепатотоксическими эффектами для предотвращения нежелательных реакций.
Диагностика синдрома Жильбера
Наиболее быстрым и точным способом диагностики синдрома Жильбера является прямая ДНК-диагностика, посредством молекулярно-генетического анализа гена UGT1A1.
Данный вид исследования основан на детекции вставки дополнительных ТА-повторов в промоторной области гена UGT1A1.
Синдром Жильбера считается подтвержденным в случае увеличения количества ТА-повторов до 7 и выше в гомозиготном состоянии (генотип А(ТА)7ТАА/А(ТА)7ТАА).
[attention type=yellow]В Центре Молекулярной Генетики данный вид анализа проводится в течение 3-х рабочих дней.
[/attention]Источник: http://www.dnalab.ru/need-to-know/gilbert-syndrome
Почему повышен уровень гомоцистеина в крови? Лечение при генетических мутациях в MTHFR, MTR, MTRR
Гомоцистеин — это серосодержащая аминокислота, которая образуется при метаболизме белка.
Впервые она была обнаружена в камне мочевого пузыря в 1933 году американским биохимиком Винсентом дю Виньо. Гомоцистеин образуется в результате метаболизма пищевого метионина, который содержится в животных белках.
Гипергомоцистеинемия — повышение уровня гомоцистеина в крови, которое может способствовать повреждению артерий и образованию тромбов в ваших кровеносных сосудах (например, тромбоз глубоких вен и тромбоэмболия легочной артерии).
Имеются эпидемиологические данные, свидетельствующие о связи между повышением гомоцистеина и нейродегенеративными состояниями, включая болезнь Альцгеймера, болезнь Паркинсона и инсульт. Повышенный уровень гомоцистеина снижает доступность АТФ для нейронов и вызывает тяжелое повреждение нервной системы.
Сывороточный гомоцистеин может служить биомаркером, используемым для оценки метилирования.
Референсные интервалы
Нормальный уровень гомоцистеина в крови составляет менее 15 микромолей на литр (мкмоль/л) крови. Повышение концентрации гомоцистеина может быть:
Умеренное: 15-30 мкмоль/л
Среднее: 30-100 мкмоль/л
Тяжелое: более 100 мкмоль/л
Причины повышения гомоцистеина
Концентрация гомоцистеина может увеличивается с возрастом. Ниже перечислены основные причины повышения гомоцистеина.
Генетические факторы
Повышение гомоцистеина может быть вызвано генетическими дефектами ферментов, которые участвуют в метаболизме гомоцистеина. Организм человека содержит более 50 триллионов клеток, и каждая клетка содержит полный набор инструкций для вас. Инструкции закодированы в вашей ДНК. Короткие сегменты ДНК называются генами.
Ваша ДНК — «кулинарная» книга, ваши гены — рецепты. Гены кодируют определенные белки, и эти белки играют решающую роль в функционировании тканей и органов организма. У людей около 20 000 генов. Среди этих 20 000 генов находятся гены MTHFR, MTR, MTRR, CBS. У большинства людей есть две копии этих генов.
Ген MTHFR необходим, чтобы сделать фермент метилентетрагидрофолатредуктазу. Когда вы едите продукты, которые содержат фолиевую кислоту (витамин B9), фермент метилентетрагидрофолатредуктаза превращает ее в метилфолат, активную форму фолата. Метилфолат является ключевым игроком в метилировании, процессе добавления метильной группы к химическому соединению.
Метилирование является основополагающим для правильного функционирования почти всех систем организма.
Купить метилфолат →
Метилфолат участвует:
- В восстановлении и регенерации ваших клеток, тканей и ДНК.
- Регуляция экспрессии генов и белков.
- В синтезе нейротрансмиттеров, которые влияют на настроение, сон, поведение, познание и память.
- В контроле гомоцистеина.
- Сдерживает воспаление под контролем.
- Помогает вашей печени в переработке жиров.
- В активации и регулировании иммунной системы.
Что делать при мутации в гене MTHFR? Метилирование чрезвычайно важно!
Те из нас, у кого есть мутации в гене MTHFR (A1298C или C677T), имеют дефектный фермент метилентетрагидрофолатредуктазу и производят на 30-70% меньше метилфолата (синонимы: метафолин, левомефолиевая кислота, метилтетрагидрофолат) чем кто не имеет данную мутацию.
Купить метилкобаламин →
Хотя знание статуса MTHFR очень важно,но оно может не отражать до конца всю клиническую картину. Исследования показывают, что ряд генов, помимо MTHFR, влияют не только на циклы метилирования, но и на вторичные побочные продукты и функцию генов. Такие гены как MTR, MTRR, COMT и AHCY играют важную роль в способности пациента к метилированию.
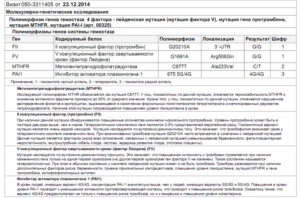
Мутация в гене MTR (A2756G) приводит к дефициту метилкобаламина. Этот цитоплазматический фермент метионинсинтаза (MTR) катализирует метилирование гомоцистеина с образованием метионина, используя 5-метилтетрагидрофолат.
Реакция протекает путем переноса метильной группы из 5-метилтетрагидрофолата с образованием метилкобаламина и последующим переносом метильной группы из метилкобаламина в гомоцистеин с образованием метионина.
При дефиците метилкобаламина также происходит повышение гомоцистеина в крови.
Купить Витамин В2 →
Ген MTRR кодирует метионинсинтазоредуктазу, фермент, который помогает восстановиться метионинсинтазе (MTR) и дальше превращать кобаламин в метилкобаламин.
[attention type=red]Мутация (A66G) в гене MTRR может привести к появлению менее эффективного или совсем неэффективного фермента. Это специфически связано с дефектами нервной трубки, колоректальным раком, сердечно-сосудистыми заболеваниями и повышенным риском синдрома Дауна.
[/attention]В сочетании с полиморфизмом MTHFR C677T генотипы MTRR AG / GG влияют на общий уровень гомоцистеина в плазме. Кроме того, комбинация генетических полиморфизмов в MTRR и MTHFR была связана с увеличением повреждения ДНК.
Витамин B2 необходим для нормальной работы фермента метилентетрагидрофолатредуктазы (MTHFR).
Купить витамин B6 →
Ген CBS кодирует фермент, называемый цистатион-бета-синтазой. Этот фермент вместе с коферментом витамином B6 необходим для превращения аминокислот гомоцистеина и серина в молекулу, называемую цистатионином.
Затем другой фермент превращает цистатионин в аминокислоту цистеин, которая используется для образования белков и глутатиона. В гене CBS было выявлено более 150 мутаций, вызывающих повышение гомоцистеина в крови.
Наличие мутации в гене CBS приводит также к гомоцистинурии. Выявить гомоцистинурию можно методом тандемной масс-спектрометрии. Такой анализ аминокислот в моче выполняют в российских лабораториях.
Генетические дефекты ферментов фолатного цикла: MTHFR, MTR, MTRR (4 точки) выявляют во многих частных лабораториях, например в KDL.
Метаболический путь синтеза и утилизации гомоцистеина. MTHFR: метилентетрагидрофолатредуктаза; MTRR: метионинсинтдрогеназа.
Диета
Повышение гомоцистеина происходит из-за неправильного питания (отсутствие необходимых пищевых компонентов).
Если человек ежедневно принимает пищу с высоким содержанием белка: мясо, яйца, курица, молоко, то также должен включать в свой рацион определенные жизненно важные аминокислоты. Отсутствие этих жизненно важных аминокислот вызывает гипергомоцистеинемию.
Потребление кофе (4 чашки в день) связано с умеренным повышением гомоцистеина. Строгие вегетарианцы часто подвергаются риску гипергомоцистеинемии из-за низкого уровня B12 в плазме.
Факторы образа жизни
Курение связано с сосудистыми заболеваниями и другими осложнениями, связанными с повышением гомоцистеина. Количество сигарет, выкуриваемых в день, является сильнейшим фактором, определяющим уровень гомоцистеина.
Никотин напрямую влияет на метилирование и катаболизирует фолатный цикл. Недостаточная физическая активность снижает концентрацию общего гомоцистеина в плазме и увеличивает вероятность развития сердечно-сосудистых заболеваний у здоровых и уже больных людей.
[attention type=green]Хроническое употребление алкоголя влияет на метаболизм фолиевой кислоты и цианокобаламина. Это связано с желудочно-кишечными нарушениями, которые приводят к снижению поглощения витаминов и фолиевой кислоты, что способствует повышению уровня гомоцистеина.
[/attention]Он также ингибирует метионинсинтазу, чтобы уменьшить поглощение печени и увеличить экскрецию с мочой.
Физическая активность играет важную роль в жизни, так как это самый дешевый способ укрепления нашего здоровья и снижения риска сердечно-сосудистых заболеваний.
Побочный эффект лекарств
Некоторые лекарства, такие как холестирамин и метформин, предотвращают всасывание витаминов из кишечника. Метотрексат, никотиновая кислота влияют на метаболизм фолиевой кислоты, тем самым и на гомоцистеин. Окскарбазепин и топирамат могут вызывать гипергомоцистеинемию из-за их способности активировать печеночные ферменты.
Болезни почек
Пациенты с почечной недостаточностью имеют чрезвычайно высокие уровни гомоцистеина из-за менее эффективного почечного клиренса гомоцистеина.
Пациенты с заболеванием почек имеют высокие показатели сердечно-сосудистой заболеваемости и смерти. Уровни гомоцистеина увеличиваются при снижении функции почек.
Основная причина гипергомоцистеинемии при заболеваниях почек еще не совсем понятна, хотя снижение скорости выведения гомоцистеина почками наиболее вероятная причина.
Распространенность
Распространенность гипергомоцистеинемии широко варьируется в зависимости от географии, пола, этнической принадлежности и возраста. Гомоцистеин повышен среди американского населения у 5-7%, у китайцев — 27,5%, у индийцев — 52-84%. Было установлено, что индийцы имеют более высокий уровень гомоцистеина, чем европейцы.
Легкая гипергомоцистеинемия встречается у 5-7% населения в целом и у 40% пациентов с сосудистыми заболеваниями. В 1990-98 годах смертность от инсульта в США падала на 0,3% в год, но после законодательного обогащения продуктами (фортификации) фолиевой кислотой в 1998 году смертность снизилась до 2,9% в год, что в 10 раз больше.
Частота полиморфизма (мутация в гене MTHFR, ответственного за повышение гомоцистеина) очень мала в некоторых популяциях (
Источник: https://www.leukoformula.com/post/hyperhomocysteinemia
Глутатион как мощное средство для лечения аутизма

Прежде всего отмечу, что любой человек – есть у него мутации или нет – должен вести здоровый образ жизни, придерживаться диеты и рекомендаций относительно экологии жилища и окружения. Это крайне важно!
Приведенные мной рекомендации по использованию пищевых добавок необходимо корректировать для каждого отдельного пациента — вне зависимости от того, какой именно тип мутации выявлен у вас. Важно работать с врачом, который хорошо знает эту сферу медицины.
Добавки, которые я описываю — это предложения, которые я мог бы рекомендовать для рассмотрения больными и врачами. Они не являются критически необходимыми, и не нужно принимать все и каждую.
Нужно сразу же оговориться, что хотя мутация MTHFRC677T присутствует у широкого круга людей, результат терапии различными пищевыми добавками может значительно отличаться от случая к случаю. Это происходит из-за наличия других генетических дефектов, образа жизни, диеты и состояния окружающей среды.
Некоторые из рекомендаций требуют более подробного пояснения, которое, однако, было бы слишком громоздким, чтобы размещать его в рамках этой статьи. Отмечу лишь то, что если рекомендация приведена – она является критически важной.
Также скажу, что представленная ниже информация приводится только для вашего сведения и не предназначена для лечения, диагностики или выписывания рецепта. Используя приведенные данные, вы действуете на свой собственный страх и риск. Всегда консультируйтесь с врачом перед приемом лекарственных средств.
Часть первая содержит советы и терапии по обоим видам мутаций — гетерозиготной (одна копия мутации C677T) и гомозиготной (две копии мутации C677T) мутаций. Часть вторая относится преимущественно к тем, у кого две копии мутантного гена, но также, если на то возникнет желание, может быть опробована и пациентами с гетерозиготной мутацией.
Основные различия между двумя видами мутаций состоят в следующем
- Гомозиготная мутация требует в большей степени избегать фолиевой кислоты
- Гомозиготная мутация требует больших количеств метилфолата
- Гомозиготная мутация требует большего разжижения крови
Вот общие рекомендации для тех, у кого есть мутация MTHFR C677T
- Ограничьте прием пищи, содержащей фолиевую кислоту, поскольку ваш организм не может хорошо ее перерабатывать.
- Ограничьте или полностью прекратите прием пищевых добавок или лекарств с фолиевой кислотой. Предварительно обсудите этот вопрос с врачом.
- Избегайте препаратов, блокирующих действие фолиевой кислоты, таких как метотрексат или противозачаточные средства.
- Избегайте лекарств, которые повышают гомоцистеин, таких как закись азота (используется стоматологами).
- Избегайте антацидов (препаратов, нейтрализующих соляную кислоту в желудочном соке), так как они блокируют усвоение витамина B12 и других питательных веществ.
- Постарайтесь определить, какие из испытываемых вами симптомов могут иметь отношение к мутации MTHFRC677T.
- Регулярно определяйте уровни гомоцистеина (делайте это должным образом! = анализ после пищевой нагрузки с метионином)
- Расскажите о выявленной у вас мутации членам семьи, чтобы они тоже могли пойти проверку на нее.
- Найдите врача, который много знает о мутациях, в частности MTHFR, или готов учиться.
- Если вы беременны, найдите гинеколога или акушера, который знает о MTHFR.
- Уберите из диеты глютен – в особенности пшеницу.
- Уберите или снизьте количество молочных продуктов в диете. Если вам все же необходимо молоко, пейте козье.
- Ходите в сауну или находите другие способы пропотеть (ванны с эпсоновой солью, спортивные занятия, йога) как минимум от 1 до 3 раз в неделю.
- Ограничьте прием готовой пищи, прошедшей промышленную обработку (то, что продается в супермаркетах и гастрономах).
- Чаще используйте в диете полезную пищу (без добавок, красителей и усилителей вкуса) и готовьте блюда дома.
- Ешьте фрукты и овощи всех цветов радуги – каждый день.
- Используйте касторовое масло, когда испытываете колики, боли и дискомфорт в брюшной полости.
- Когда у вас болит живот, переходите на диету из овощей и фруктов с семенами чиа (испанского шалфея).
- Если у вас повышен уровень гомоцистеина, ограничьте прием пищи, богатой метионином (яйца, кунжут, курица, тунец и другие).
- Клизмы с кофе, когда вы проходите детоксикацию или испытываете боль.
- Пейте воду без хлора, принимайте ванну и душ в нехлорированной воде.
- Выпивайте как минимум два литра чистой (фильтрованной) воды, в которой должен присутствовать витамин С и электролиты.
- Ешьте меньше, но чаще, в каждой пище должна присутствовать какая-то форма белка.
- Ограничьте прием белка до уровня примерно 0,7 грамма на килограмм веса тела.
- У вас во рту не должно быть пломб и других стоматологических работ с использованием ртути. Если они все еще присутствуют – замените их у опытного стоматолога.
- Избегайте пластиковых контейнеров – не готовьте в них, не пейте из них, не храните в них еду и не подогревайте в них пищу.
- Пользуйтесь очистителями воздуха дома и в офисе.
- Уберите из дома ковры и вместо них покройте пол плиткой или деревом, которое не дает испарений при комнатной температуре.
- Ешьте говядину из коров, которые питались травой на пастбищах, мясо животных, которые не принимали антибиотики и гормоны, а также яйца.
- Готовьте на электричестве, не используйте газовую плиту и духовку.
Общие рекомендации по пищевым добавкам при мутации MTHFR C677T
- Метилфолат
- Метилкобаламин (витамин В12)
- Бетаин в форме TMG
- N-ацетилцистеин
- Глутатион
- Витамин В6 (пиридоксальфосфат)
- Витамин В2 (рибофлавин)
- Куркумин
- Витамин Е (токоферолы)
- Силимарин (экстракт семян расторопши)
- Рыбий жир
- Фосфатидилхолин
- Наттокиназа
- Витамин С
- Витамин В3
- Пробиотики
- Мультивитаминные комплексы с широким набором минералов
Стандартные фармакологические рекомендации при мутации MTHFR C677T
Существует большое количество фармпрепаратов, которые выписывают при мутациях MTHFRC677T.
Часто они являются плохим выбором, поскольку содержат неэффективную форму витамина В12, небольшие количества витамина В6 (или вообще обходятся без него), или неверную форму фолиевой кислоты.
Кроме того, все нижеперечисленные лекарства содержат пищевые красители и консерванты, которых стоит избегать:
- Деплин (дозировки 7,5 мг и 15 мг)
- Церефилин с N-ацетилцистеином
- Метанкс
- Эноксапарин натрия (торговые марки Лавнокс, Клексан, Нексиум, Ксапарин)
- Детский аспирин
Пренатальные рекомендации при выявленной мутации MTHFR C677T
Вам нужны пренатальные медикаменты, которые содержали бы метилфолат, фолиновую кислоту и не содержали бы фолиевую кислоту.
Такие средства трудно найти: большая часть доступных на рынке препаратов содержит только фолиновую кислоту, но не содержит метилфолат, который требуется, чтобы обойти мутацию MTHFRC677T.
Фолиновая кислота, необходимая на случай, если подавлено действие гена MTR, не будет работать в отсутствии метилфолата.
Пищевые добавки, которые можно порекомендовать при мутации MTHFR C677T
Хотя я рекомендую эти добавки, я никогда не даю совета принимать их все и сразу.
Начните с приема малой дозы самой важной добавки (она индивидуальна для каждого пациента). Подождите несколько дней, чтобы увидеть, как реагирует ваш организм. Если реакция положительная, продолжайте прием и добавляйте другую добавку. Этот способ поможет вам определить, какая из добавок плохо влияет на ваше самочувствие.
Говоря в общем, у пациентов с мутацией MTHFRC677T снижена способность к синтезу метилфолата, возрастает риск сердечно-сосудистых заболеваний, повышается риск тромбоза.
Такие пациенты страдают от болей и воспалений, и у них возрастает чувствительность к химическим веществам. Нижеприведенные рекомендации помогают смягчить описанные негативные симптомы, укрепив путем приема пищевых добавок природную способность организма к восстановлению своих функций.
Источник: http://www.corhelp.ru/metody-korrektsii/biomed/mutatsiya-mthfr-c677t-osnovnoj-protokol-lecheniya/
Мутации генов гемостаза MTHFR – что это значит и что с этим делать

Мутация гена MTHFR является проблемой, связанной с плохим метилированием и продукцией ферментов. Мутации генов гемостаза MTHFR влияют на каждого человека по-разному. Иногда они приводят к едва заметным симптомам, а иногда приводят к серьезным, долговременным проблемам со здоровьем.
Хотя точный показатель распространенности все еще остается предметом дискуссий, считается, что 30%-50% всех людей могут иметь мутацию в гене MTHFR, который наследуется и передается от родителя к ребенку.
Как правило, это гетерозиготная мутация. Приблизительно от 14% до 20% процентов населения могут иметь более тяжелую мутацию MTHFR, которая более резко влияет на общее состояние здоровья.
Она называется гомозиготной мутацией.
Разница состоит в том, что гетерозигота – это мутация в одной аллели пары генов. То есть шанс ее проявления составляет 50%. А гомозигота – мутация в обеих аллелях пары генов, проявление в 100% случаев.
Мутация гена MTHFR была обнаружена во время завершения проекта генома человека. Исследователи поняли, что люди с этим типом наследственной мутации имели большую вероятность развития определенных заболеваний. К ним относятся: СДВГ, болезнь Альцгеймера, атеросклероз, аутоиммунные расстройства и аутизм.
Еще многое предстоит узнать о том, что означает этот тип мутации для людей, которые несут ее и продолжают передавать своим детям.
На сегодняшний день существуют десятки различных состояний здоровья, связанных с мутациями MTHFR. Но еще раз подчеркнем, что даже если вы являетесь носителем мутации – не факт, что у вас будут ее проявления. Мутация означает лишь повышение рисков.
Что такое мутация генов MTHFR
MTHFR — это ген, который обеспечивает организм инструкциями по производству определенного фермента, называемого метилентетрагидрофолатредуктаза . То есть MTHFR — сокращенное название этого фермента.
Есть две основные мутации MTHFR, на которых исследователи фокусируются чаще всего. Эти мутации часто называют «полиморфизмами» и влияют на гены, называемые MTHFR C677T и MTHFR A1298C.
Также эти мутации называют – мутациями фолатного цикла, потому что они показывают, как организм преобразует фолиевую кислоту в активную форму для наилучшего усвоения.
[attention type=yellow]Соответственно, если у вас есть мутации генов гемостаза MTHFR, то ваш организм плохо усваивает фолиевую кислоту и другие витамины группы B, особенно В12. Что делать в этом случае – читайте далее.
[/attention]Мутации могут происходить в разных местах этих генов и наследоваться только от одного или обоих родителей. Наличие одного мутантного аллеля связано с повышенным риском определенных проблем со здоровьем, но наличие двух увеличивает риск намного больше.
Мутация гена MTHFR может изменить способ, которым некоторые люди метаболизируют и преобразовывают важные питательные вещества из своего рациона в активные витамины, минералы и белки.
Генетические мутации также могут изменять уровни нейротрансмиттеров и гормонов.
В некоторых случаях, хотя и не во всех, изменения в работе этого фермента могут влиять на параметры здоровья, включая уровень холестерина, функцию мозга, пищеварение, эндокринные функции и многое другое.
Часть о мутациях генов гемостаза MTHFR впервые узнают после анализа причин замершей беременности
1. Потребляйте больше натурального фолата, витамина В6 и витамина В12
В случае с мутациями генов фолатного цикла важно употреблять много продуктов, богатых витаминами B6, B9 и B12.
Вы также можете принимать их в виде добавки. Однако, помните, что людям с мутациями MTHFR труднее переводить синтетическую форму фолиевой кислоты в биодоступную. Более того, прием обычной фолиевой кислоты может вызвать ухудшение симптомов.
Получение достаточного количества фолиевой кислоты особенно важно до и во время беременности. За три месяца до зачатия и в течение первого триместра беременности матери, которые получают достаточно фолиевой кислоты, снижают риск развития у детей различных проблем со здоровьем.
Людям с мутациями MTHFR критически важно получать биодоступные формы фолата в добавках, называемых L-метилфолатом или метильной формой витамина В9.
L-метилфолат сложнее упаковывать в форме капсул, поэтому вы, возможно, не сможете получать очень высокие дозы в типичных поливитаминах или добавках. Поэтому рекомендуется принимать моно-добавки под называнием 5-MTHF.
Now Foods, Метилфолат, 5000 мкг, 50 вегетарианских капсул
Thorne Research, 5-МТГФ, 5 мг, 60 капсул
Если у вас обнаружена мутация MTHFR в форме гомозиготы, то метильные комплексы фолиевой кислоты вам необходимо пропивать постоянно курсами — минимум 3 раза в год.
Наличие большего количества фолиевой кислоты в вашем рационе означает, что вы лучше способны создавать активную форму 5-MTHF. Некоторые из лучших продуктов с высоким содержанием фолиевой кислоты включают в себя:
- Фасоль и чечевица
- Листовые зеленые овощи, такие как сырой шпинат
- Спаржа
- Ромэн
- Брокколи
- Авокадо
- Яркие фрукты, такие как апельсины и манго
Источник: https://blisswoman.ru/shemy/mutatsii-genov-gemostaza-mthfr-chto-eto-znachit-i-chto-delat/